Cada año, millones de vidas se ven transformadas repentina y rápidamente por un derrame cerebral, que ocurre cuando un vaso sanguíneo que viaja al cerebro se bloquea, provocando la muerte de neuronas. Los accidentes cerebrovasculares se encuentran entre las principales causas de discapacidad en adultos y se estima que una de cada seis personas sufrirá uno en algún momento de su vida.
El cerebro humano es, con diferencia, el órgano más complejo de nuestro cuerpo. Su sofisticada arquitectura celular y redes neuronales nos brindan lenguaje, memoria y pensamiento abstracto. Pero esta complejidad tiene un precio, ya que el tejido cerebral tiene una capacidad muy limitada de regenerarse. A diferencia de la piel o el tejido hepático, las neuronas que mueren rara vez son reemplazadas.
Por este motivo, las lesiones cerebrales son la causa fundamental de muchas enfermedades relacionadas con la edad. Uno de los más graves y comunes es el ictus isquémico, provocado por la interrupción del flujo sanguíneo al cerebro. Aunque los avances en el tratamiento de urgencia han mejorado las tasas de supervivencia, actualmente no existe ninguna terapia que pueda reparar el daño neuronal causado por el ictus.
Incidencia internacional de accidentes cerebrovasculares y cobertura sanitaria. En cada ‘planta’, los pétalos muestran la incidencia de accidentes cerebrovasculares por cada 100.000 personas y las raíces muestran la presión sobre el sistema de salud de cada país. Datos obtenidos de World Data Bank (2023), Stroke Association Europe (2017) y Stroke Foundation (2024). Elaborado por: Santiago Ramos
La rehabilitación ayuda a restaurar algunas funciones, pero en muchos casos, los sobrevivientes de un accidente cerebrovascular viven con deficiencias motoras y cognitivas permanentes, así como con un mayor riesgo de depresión, demencia y otras enfermedades neurodegenerativas. Sin embargo, eso podría cambiar pronto gracias al desarrollo de terapias basadas en células madre.
Leer más: De la anticoncepción a la menopausia: por qué las mujeres corren un mayor riesgo de sufrir un accidente cerebrovascular
Un nuevo horizonte terapéutico
En las últimas décadas, las terapias celulares han abierto la puerta a una nueva generación de tratamientos en medicina regenerativa. Se trata de terapias que buscan reemplazar o reparar el tejido dañado mediante la introducción de nuevas células capaces de sobrevivir, madurar y eventualmente realizar las funciones que se han perdido.
Esto es especialmente importante para las enfermedades que afectan al cerebro. A pesar de su gran potencial, la medicina regenerativa se está desarrollando relativamente lentamente porque necesita cumplir con la legislación de diferentes regiones. También requiere grandes inversiones financieras.
Un precedente clave ocurrió a finales de la década de 1980 en el Hospital Universitario de Lund en Suecia, donde un equipo dirigido por Anders Björklund y Ole Lindvall trasplantó con éxito células madre neurales en el cerebro de pacientes con enfermedad de Parkinson. La enfermedad de Parkinson es un trastorno neurodegenerativo caracterizado por la pérdida progresiva de neuronas dopaminérgicas, esenciales para controlar los movimientos corporales.
Los resultados fueron notables: al reemplazar las neuronas dañadas, muchos pacientes recuperaron la función motora durante más de una década. Estos experimentos proporcionaron la primera evidencia sólida de que el cerebro humano puede repararse utilizando células vivas.
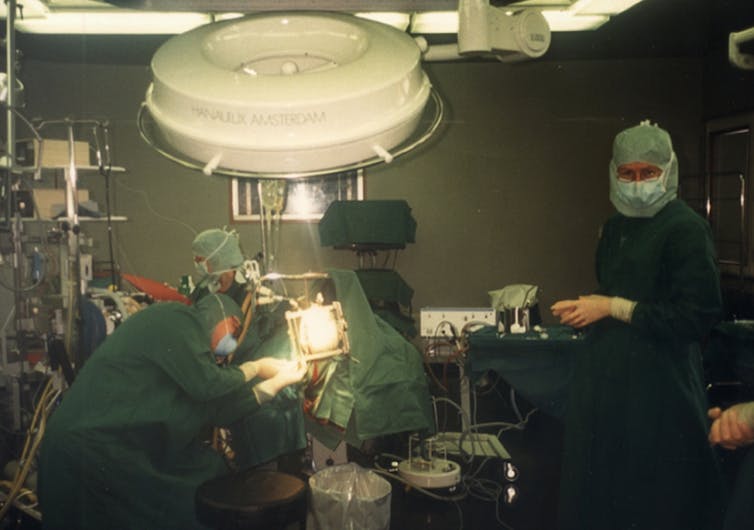
El equipo de Anders Björklund y Olle Lindvall se está preparando para trasplantar células fetales a uno de los pacientes de Parkinson que participaron en el primer estudio. Esta intervención pionera marcó un punto de inflexión en el uso de la terapia celular en neurología. Olle Lindvall.
Desde entonces, la investigación ha avanzado, las técnicas se han perfeccionado y la normativa europea ha establecido marcos estrictos para garantizar la seguridad y la calidad de estos tratamientos, que ahora se clasifican como fármacos de terapia avanzada. Actualmente se están llevando a cabo varios ensayos clínicos en todo el mundo que continúan el trabajo de Björklund y Lindvall y ofrecen esperanza a los pacientes con Parkinson y muchas otras enfermedades que afectan al cerebro.
El desafío único de los trazos
Aunque esta historia ha inspirado muchos estudios, los accidentes cerebrovasculares presentan un desafío diferente a la enfermedad de Parkinson. El daño isquémico suele ser mayor. También afecta no solo a un tipo de célula, sino a múltiples poblaciones de neuronas, células gliales y vasos sanguíneos.
Además, no basta con que las células trasplantadas sobrevivan en el cerebro del paciente: deben estar funcionalmente integradas. Esto significa que deben enviar sus axones (las extensiones que transportan los impulsos nerviosos) y hacer sinapsis, o conexiones adecuadas, con las neuronas supervivientes, convirtiéndose así en parte del circuito del cerebro.
Es comparable a reconstruir un puente roto y el tráfico que lo cruza: las conexiones deben realizarse de la manera correcta para que la información fluya. Por lo tanto, además de agregar nuevas células, el desafío del accidente cerebrovascular es reconectar efectivamente el cerebro.
La promesa de la ingeniería genética
Aquí es donde entra en juego la ingeniería genética, una de las tecnologías más transformadoras de la biología moderna. Esta disciplina permite modificar las células para que sean más eficientes, resistentes o mejor integradas en el tejido dañado.
En nuestro caso, incorporamos a las células trasplantadas un gen que codifica la proteína BDNF (Brain-Driven Neurotrohic Factor), un factor neurotrófico que ayuda al desarrollo del cerebro y favorece el crecimiento de axones y la formación de sinapsis. El objetivo es facilitar la integración funcional de nuevas neuronas en el cerebro lesionado, un paso clave para garantizar que el trasplante no sólo llene el vacío, sino que también restablezca la comunicación neuronal.
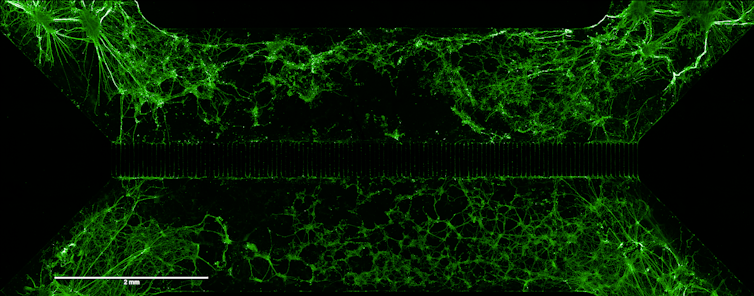
Imagen de cultivos neuronales derivados de células madre que crecen en un dispositivo de microfluidos con dos compartimentos conectados por microcanales (400 μm). La sobreexpresión de BDNF en el compartimento inferior promueve el crecimiento y la proyección de axones del compartimento opuesto, lo que demuestra el papel de este factor en la integración y conectividad neuronal. Adaptado de IJMS. Una cuestión de ética
La manipulación genética también plantea dilemas éticos, especialmente en cuanto a los límites de su aplicación y sus posibles efectos a largo plazo. Los trasplantes mencionados en pacientes con enfermedad de Parkinson, por ejemplo, se realizaron con células de tejido fetal.
Hoy, gracias al trabajo del investigador japonés Shinya Yamanaka, premio Nobel de Medicina 2012, y su descubrimiento de las células madre pluripotentes inducidas (iPS), es posible generar células madre a partir de células adultas del propio paciente. Ahora es muy común que las células iPS se generen en el laboratorio a partir de biopsias de piel.
Esto evita muchos de los conflictos éticos asociados con el uso de embriones y reduce el riesgo de rechazo inmunológico. Por tanto, la cuestión ya no es si podemos modificar las células para reparar el cerebro, sino qué criterios utilizar, según qué normativa y con qué responsabilidad.
La historia de la medicina está hecha de pequeñas victorias contra lo imposible. Hace apenas unas décadas, la idea de tratar un cerebro dañado por un derrame cerebral habría parecido completamente impensable. Hoy, gracias a una combinación de biología, ingeniería genética y medicina regenerativa, empieza a tomar forma en los laboratorios. Quedan muchos desafíos por resolver, pero cada nuevo avance nos recuerda algo importante: el cerebro no sólo puede aprender, sino que también puede repararse a sí mismo.
Descubre más desde USA Today
Suscríbete y recibe las últimas entradas en tu correo electrónico.








