Las enzimas son máquinas moleculares que realizan reacciones químicas que mantienen toda su vida, la capacidad de atrapar a los científicos como yo.
Considere un movimiento muscular. Su cuerpo libera una molécula llamada acetilholina para iniciar las células musculares con el contrato. Si es demasiado largo, qué acetilcolina está bajando, puede paralizar los músculos, incluidas las células del corazón, y, bueno, eso es todo. La enzima de la acetilcolinesterasa entra en la enzima aquí. Esta enzima puede romper miles de moléculas de acetilcolina por segundo para garantizar la detención de la contracción muscular, se evita la parálisis y la vida continúa. Sin esta enzima, la molécula de acetilcolina tarda un mes en romper solo, aproximadamente 10 mil millones de tiempo más lento.
Puede imaginar por qué las enzimas son de especial interés para los científicos que desean resolver problemas modernos. ¿Qué pasa si hay una manera de romper plástico, atrapar dióxido de carbono o destruir las células cancerosas que es rápida a medida que la acetilcolinesterasa rompe la acetilcolina? Si el mundo tome medidas rápidamente, las enzimas son un candidato de trabajo convincente, si solo los investigadores pudieran diseñarlos para enfrentar estos desafíos a pedido.
Desafortunadamente, diseñar enzimas es muy difícil. Es como trabajar con el LEGO en el átomo, pero las instrucciones se pierden y la cosa no se mantendrá unida si no se cumple perfectamente. La investigación recientemente publicada de nuestro equipo indica que el aprendizaje automático puede actuar como arquitecto en este LEGO, ayudando a los científicos a construir con precisión estas estructuras moleculares complejas correctamente.
¿Cuál es la enzima?
Miremos más cerca de lo que hace una enzima.
Las enzimas son proteínas, grandes moléculas que funcionan detrás de la casa trabajando en todos los seres vivos. Estas proteínas están formadas por aminoácidos, un conjunto de bloques de construcción que pueden controlarse juntos para formar secuencias largas que se insertan en ciertas formas.
La estructura específica de la proteína es clave para su función de la misma manera en que son las formas de las instalaciones cotidianas. Por ejemplo, como una cuchara diseñada para mantener los fluidos de tal manera que el cuchillo simplemente no puede, las enzimas involucradas en mover su músculo no son adecuadas para la fotosíntesis en las plantas.
Para que funcione una enzima, adopta un formulario que se corresponde perfectamente con la molécula que procesa, de manera similar, ya que el bloqueo coincide con la llave. Los surcos únicos en la enzima, el bloqueo, que se comunica con la molécula objetivo, la clave, se conocen en la región de la enzima como un lugar activo.
El modelo de ajuste inducido de enzimas establece que la enzima y su sustrato cambian la forma al comunicarse. OpenStaks, CC BI-SA
Un lugar activo de los aminoácidos orientados con precisión para la interacción con la molécula objetivo al ingresar. Esto hace que sea más fácil las moléculas pasar la reacción química para convertirse en diferente, lo que hace que el proceso sea más rápido. Después de que se completó la reacción química, se libera la nueva molécula y la enzima está lista para el procesamiento de otra.
¿Cómo se diseñas una enzima?
Los científicos han pasado décadas tratando de diseñar sus enzimas para hacer nuevas moléculas, materiales o terapias. Pero hacer enzimas que parecen ir tan rápido como se encontraron en la naturaleza increíblemente difícil.
Las enzimas tienen formas complejas e irregulares compuestas por cientos de aminoácidos. Cada uno de estos bloques de construcción debe colocarse perfectamente u otro que la enzima se ralentice o se apagará por completo. La diferencia entre la velocidad del corredor y la desaceleración puede ser menor que el ancho de un átomo.
Inicialmente, los científicos se centraron en la modificación de las secuencias de aminoácidos de las enzimas existentes para mejorar su velocidad o estabilidad. Los primeros éxitos con este enfoque han mejorado principalmente la estabilidad enzimática, lo que les permite catalizar las reacciones químicas a un rango de temperatura más grande. Pero este enfoque fue menos útil para mejorar la velocidad de la enzima. Hasta la fecha, el diseño de nuevas enzimas modificando los aminoácidos individuales generalmente no es una forma efectiva de mejorar las enzimas naturales.
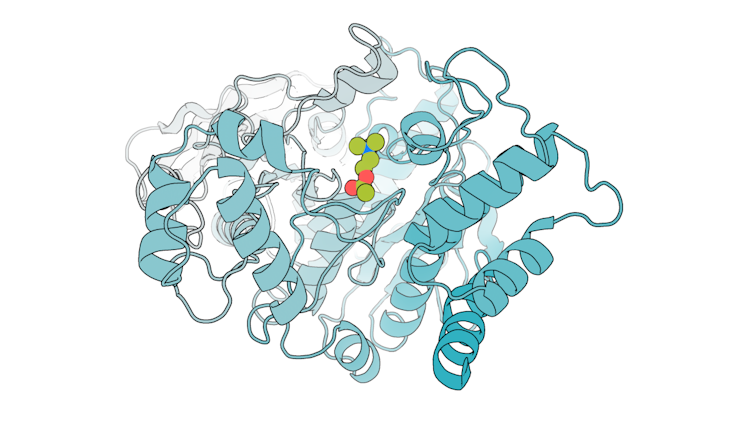
Este modelo de acetilholinesterasa muestra acetilcolina (verde) atada a su lugar activo. Sam Pellock, CC BI-SA
Los investigadores encontraron que el uso de un proceso llamado evolución direccional, en la que la secuencia de aminoácidos de enzimas cambia aleatoriamente hasta que la función deseada demostró ser mucho más fructífera. Por ejemplo, los estudios han demostrado que una evolución enfocada puede mejorar la velocidad de la reacción química, la termostabilidad e incluso las enzimas generadas con propiedades que no se ven en la naturaleza. Sin embargo, este enfoque generalmente funciona intenso: debe sentarse mucho mutante para encontrar el que desea. En algunos casos, si no hay buena enzima para comenzar, este método no puede tener éxito en absoluto.
Ambos enfoques están limitados por la confianza en las enzimas naturales. Es decir, es probable que limitar su diseño en las formas de proteínas naturales limite los tipos de productos químicos que las enzimas pueden facilitarlo. Recuerda, no puedes comer un cuchillo de caldo.
¿Es posible hacer enzimas desde cero, no cambiar la prescripción de la naturaleza? Sí, con una computadora.
Diseño de enzimas con computadora
Los primeros intentos de contar enzimas que aún dependen en gran medida de las enzimas naturales como punto de partida, centrándose en la instalación de sitios activos en proteínas naturales.
Este enfoque es similar a un intento de encontrar el tráfico de austing: es poco probable que encuentre perfectamente, porque la geometría de la enzima es muy específicamente, por lo que una proteína aleatoria es una estructura fija (traje con mediciones aleatorias) es probablemente el lugar perfecto. Las enzimas obtenidas de estos esfuerzos funcionaron mucho más lentamente que aquellas que encontraron en la naturaleza, exigiendo una mayor optimización con una evolución direccional para alcanzar velocidades de común entre las enzimas naturales.
El progreso reciente en el aprendizaje profundo ha cambiado el panorama del diseño de enzimas con una computadora. Las enzimas ahora se pueden generar de la misma manera en que los modelos de IA, como Chatgtpt y Dall, están generando texto o imágenes, y no necesita usar estructuras de proteínas originales para admitir su lugar activo.
Y las herramientas ayudan a los investigadores a diseñar nuevas proteínas.
Nuestro equipo ha demostrado que cuando enviamos y modelamos, llamamos RFDiffusion, a lo largo de la estructura y la secuencia de aminoácidos de un lugar activo, puede generar el resto de la estructura enzimática que lo respaldaría perfectamente. Es equivalente alentar a ChatgGPT a escribir una historia corta completa basada en la solicitud en la consulta que solo dice que la inclusión de la línea “y desafortunadamente, los huevos nunca aparecieron”.
Utilizamos este modelo de IA específicamente para generar enzimas llamadas serina hidráulis, un grupo de proteínas que tienen una aplicación potencial en medicina y reciclaje de plástico. Después de diseñar enzimas, las mezclamos con su objetivo molecular planificado para ver si podían catalizar su fracaso. Alentador, muchos de los diseños que probamos podrían romper la molécula y mejores enzimas previamente diseñadas para la misma reacción.
Para ver cuán preciso nuestro diseño de cálculo, utilizamos un método llamado cristalografía de rayos X para determinar las formas de estas enzimas. Descubrimos que muchos de ellos son casi la pareja perfecta con lo que diseñamos digitalmente.
Nuestros hallazgos indican un progreso clave en el diseño de enzimas, señalando cómo y pueden ayudar a los científicos a comenzar a lidiar con problemas complejos. La herramienta de aprendizaje automático podría ayudar a más investigadores a acceder al diseño de enzimas y a tocar todo el potencial enzimático para resolver problemas modernos.
Descubre más desde USA Today
Suscríbete y recibe las últimas entradas en tu correo electrónico.









