“¿Qué es el radio y por qué es peligroso?” – Aurora, 10, Laredo, Texas
El elemento radio se puede encontrar en cantidades extremadamente pequeñas en el país y en los océanos del país y en su forma pura es un metal plateado blando. Para un ojo inexperto, un pequeño trozo de radio puede parecer un fragmento de una roca gris normal. Pero el radio puede transmitir radiación (energía y pequeños fragmentos de sí mismos) que no se puede sentir, ver ni oler. Y esa radiación invisible puede hacerte daño sin que te des cuenta, incluso lo notas inmediatamente.
¿Qué sucede con esta amenaza silenciosa que disminuye su cuerpo de maneras que pueden tardar años en descubrirse?
Como químico, me interesa saber qué hace que diferentes elementos sean seguros o peligrosos de manipular. Esta peligrosa liberación de radiación se llama radiactividad, por lo que aunque su origen pueda parecer despreocupado, puede quemarte o incluso provocarte enfermedades que no se manifiestan durante años.
Átomos e isótopos
Todo lo que ves a tu alrededor (tu piel, rocas, páginas de libros) simula diferentes combinaciones de partículas extremadamente pequeñas llamadas átomos.
El átomo tiene un centro pequeño y grueso llamado núcleo. Las partículas acusadas negativas contenidas en los electrones se mueven a lo largo del núcleo. Dentro del núcleo hay dos tipos de partículas: protones recolectados positivamente y neutrones neutros.
Todos los átomos con el mismo número de protones en su núcleo son el mismo elemento. Además del radio, algunos elementos que habrás oído que son el carbono y el oxígeno. Todos los átomos de carbono tienen seis protones y todos los átomos de oxígeno tienen ocho protones. Los átomos de radio son mucho más duros: todos los átomos de radio tienen 88 protones.
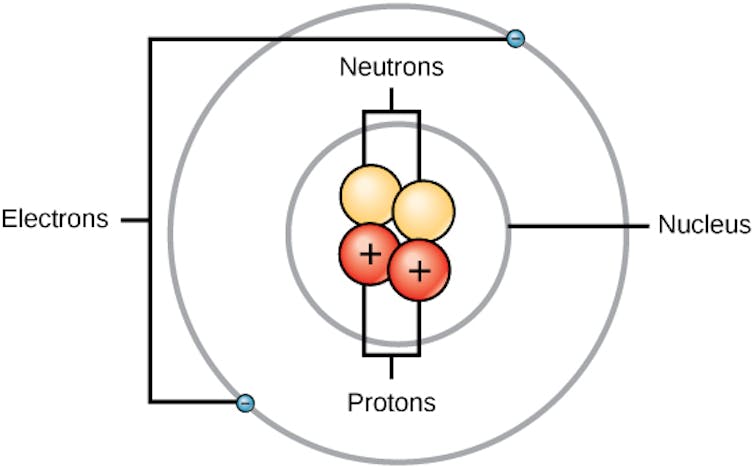
El modelo simplificado de átomo, donde el núcleo, que contiene neutrones y protones cargados positivamente, se encuentra en el centro rodeado de electrones aplicados negativamente. CNKS Openstaks / Vikimedia Commons, CC
Es interesante que es posible que átomos de un mismo elemento tengan diferente número de neutrones. Los átomos de un mismo elemento con distinto número de neutrones se llaman isótopos. Por ejemplo, dos átomos de carbono tendrían seis protones, pero éste podría tener seis neutrones, mientras que otros podrían tener siete u ocho.
La cantidad de protones y neutrones empaquetados en el núcleo determina si el isótopo del núcleo es estable o no. Si Jul no es estable, pueden ocurrir problemas.
desintegración radiactiva
El núcleo de cada átomo quiere ser estable, pero sólo ciertas disposiciones de protones y neutrones pueden lograrlo. No es necesario que el número de protones y neutrones sea igual, pero algunas combinaciones crean una coexistencia feliz o estable en el núcleo, mientras que otras no.
El núcleo con una desafortunada mezcla de protones y neutrones podría romperse de alguna manera o empeorar. Este proceso se llama radiactividad o disminución radiactiva.
Los elementos son radiactivos si se desintegran liberando partes del núcleo o partículas altas. Armtuk/Vikimedia Commons, CC
Este proceso de disminución radiactiva está liberando alguna forma de radiación del núcleo. Esta radiación puede presentarse en forma de pequeñas partículas que se mueven rápidamente o de ondas electromagnéticas de alta energía que aparecen desde el núcleo. Es la radiación (partículas y ondas de alta energía disparadas desde el núcleo de núcleos atómicos inestables) lo que puede enfermarlo.
Existen diferentes tipos de disminución radiactiva. En un caso, el átomo se desintegra formando un pequeño fragmento, que está compuesto por dos protones y dos neutrones. Dado que la cantidad de protones determina qué elemento tenemos, la desintegración que cambia la cantidad de protones en el átomo lo convierte en otro elemento.
La disminución radiactiva puede ser bastante lenta. Pueden pasar miles de años hasta que un elemento falla ante otro.
caso de radio
Todos los átomos de radio son inestables y radiactivos. Muchos de estos isótopos se desintegran muy rápidamente, pero el RA-226, que tiene 138 neutrones y 88 protones y es el más común, se ralentiza. Se necesitan 1.600 años para que la mitad del RA-226 se rectifique por deterioro.
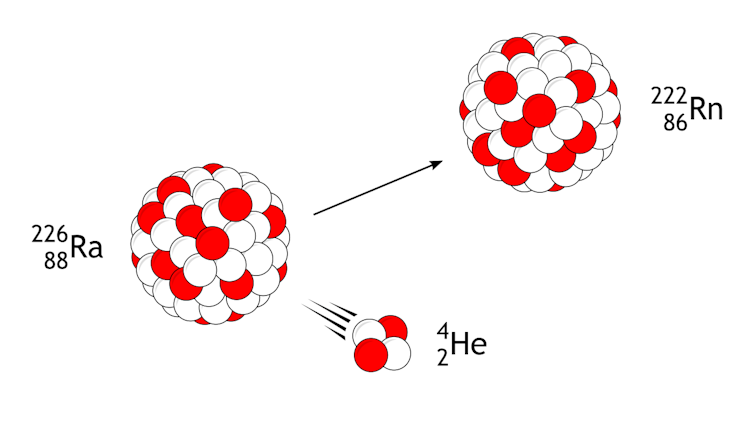
El radio sufre desintegración alfa, donde pierde el fragmento de su núcleo que contiene dos protones y dos neutrones, tras lo cual se convierte en radón. Mikerun / Vikimedia Commons, CC Bi-SA
Al desintegrarse, RA-226 pierde dos protones y dos neutrones, lo que lo convierte en el isótopo radón. Entonces el radón falla y el átomo finalmente alcanza una forma estable como la del elemento conducido. Cada paso en esa serie de desintegración libera más radiación nuclear.
Algunos otros elementos en la naturaleza sin isótopos estables son el polonio, el actinio y el uranio.
Efectos en el cuerpo humano.
La radiación nuclear se transmitió cuando el radio y otros elementos en descomposición pueden dañar las células del cuerpo humano. Puede provocar cáncer u otros problemas de salud.

Marie y Pierre Curie experimentaron con un radio, lo que acabó provocándoles complicaciones saludables. André Castiigne
Si se expone rápidamente a una gran cantidad de radiación, como un error al caminar durante varias horas con material radiactivo en el bolsillo, partículas de alta energía y ondas electromagnéticas de la radiación nuclear, incluidos problemas de salud graves, como sagore y cáncer.
Excepcionalmente, aunque la radiactividad es una amenaza para la vida, los científicos pueden controlarla y utilizarla para el diagnóstico y tratamiento de enfermedades, incluido el cáncer. Si la radiación se aplica con precisión a las células cancerosas, la radiación puede destruir a estos ladrones de células que causan estragos en el cuerpo.
Las personas que trabajan profesionalmente con materiales radiactivos deben seguir estrictas pautas y procedimientos para protegerlos. Utilizan escudos especiales y detectores de radiación y minimizan el tiempo que están expuestos a la radiactividad.
Pierre y Marie Curie, que descubrieron radio en 1898, sufrieron algunos efectos negativos de la radiactividad. Pierre sufrió quemaduras radiactivas y Marie murió de una enfermedad de la sangre, que probablemente provocó una exposición crónica a la radiación. Más de 100 años después, sus cuadernos siguen siendo radiactivos.
Y como la curiosidad no tiene fronteras de edad, adultos, cuéntanos lo que te estás preguntando. No podremos responder todas las preguntas, pero haremos nuestro mejor esfuerzo.
Descubre más desde USA Today
Suscríbete y recibe las últimas entradas en tu correo electrónico.









